L'energia di ionizzazione (indicata con il simbolo Ei) è l'energia minima necessaria per strappare un elettrone a un atomo libero.Questa dipende dalla forza con cui ogni elettrone è attratto dal nucleo e, dato che gli elettroni e i protoni hanno la carica elettrica con lo stesso valore assoluto ma di segno opposto, convenzionalmente -1 e +1, di conseguenza l'energia per strappare un.. L'energia di ionizzazione, che è la quantità di energia necessaria per separare un elettrone da un atomo, è importante per la fisica e la chimica. Ionizzando un atomo, viene rimosso un elettrone e viene aggiunto uno ione positivo, modificando l'intera struttura dell'atomo. Quando ionizzato, l'atomo non può creare legami normali.

PPT L' atomo e la sua struttura PowerPoint Presentation, free download ID5720091

PPT Tavola periodica e proprietà periodiche PowerPoint Presentation ID5742625

PPT IL SISTEMA PERIODICO PowerPoint Presentation, free download ID3492788

PPT LEZIONE 4 PowerPoint Presentation, free download ID5693765

PPT LEZIONE 4 PowerPoint Presentation, free download ID5693765

Funzioni periodiche Energia di ionizzazione YouTube

LE PROPRIETÀ PERIODICHE Microlearning

Lz ZT C09 9.4 Energia di ionizzazione e livelli energetici Video Zanichelli YouTube

PPT La configurazione elettronica e tavola periodica PowerPoint Presentation ID5400704
Energie di ionizzazione definizione e caratteristiche Blog ufficiale dell'Università
L'angolo della Geologia Energia di ionizzazione, affinità elettronica ed elettronegatività
PPT LEZIONE 4 PowerPoint Presentation, free download ID5693765
PPT Tavola periodica e proprietà periodiche PowerPoint Presentation ID7058587

PPT Chimica e laboratorio PowerPoint Presentation, free download ID5929645
Energia di Ionizzazione Cos'è e Come Funziona

Energia di ionizzazione Appunti di Chimica Docsity

Energia di ionizzazione YouTube

Lezioni di chimica Atomo 13 (Energia di ionizzazione, raggio atomico) YouTube

PPT La configurazione elettronica e tavola periodica PowerPoint Presentation ID5400704

Periodic Trends in Ionization Energy CK12 Foundation
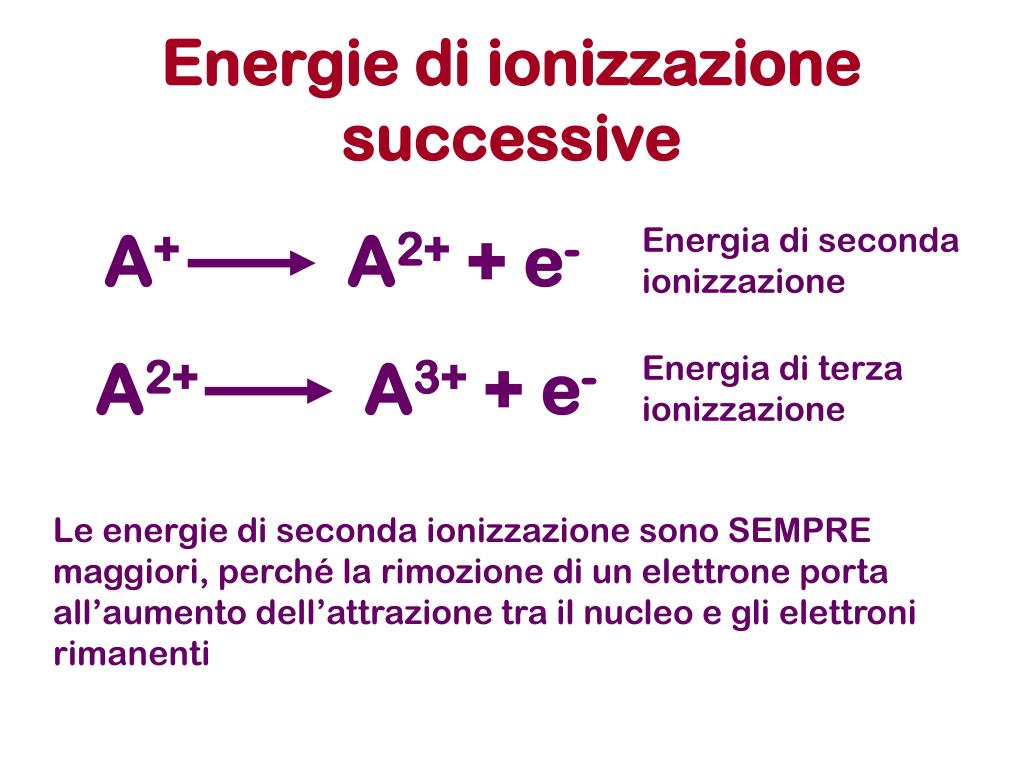
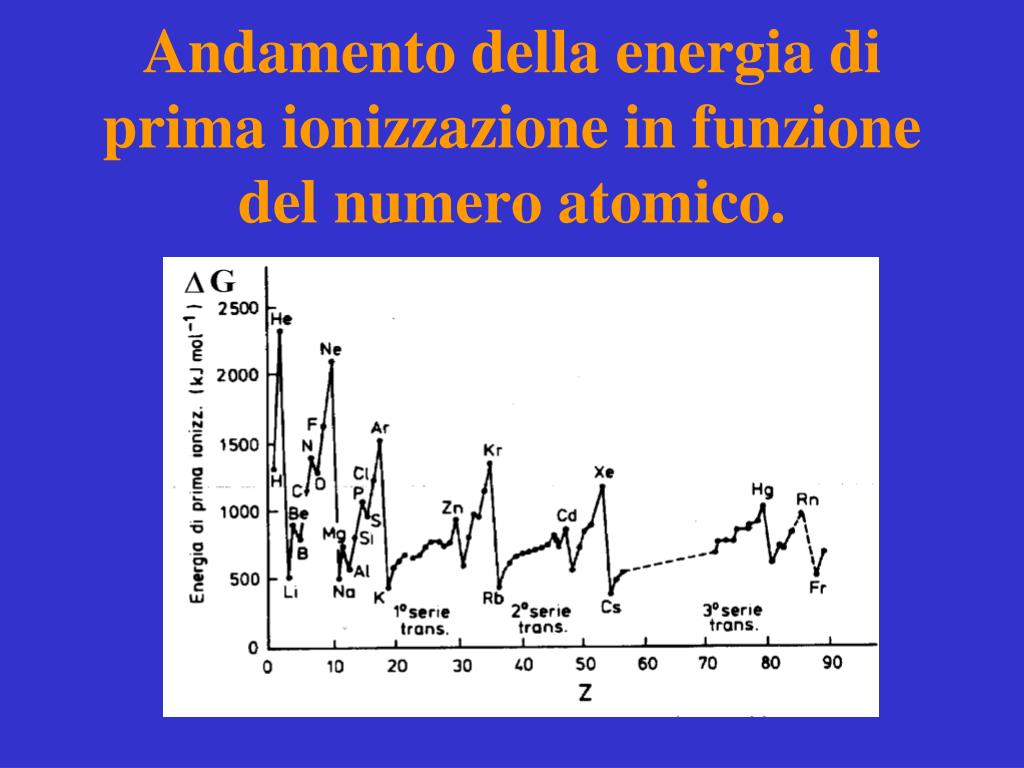
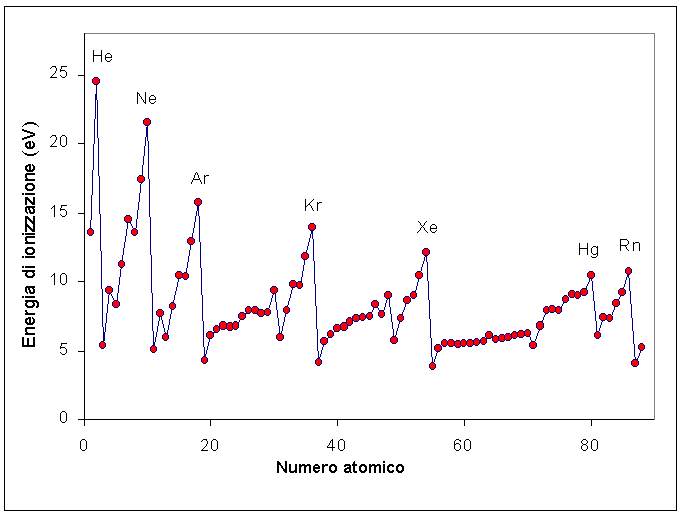
Si definisce energia di prima ionizzazione l'energia, espressa in Kcal/mol (o KJ/mol), necessaria ad una mole di atomi allo stato gassoso per trasformarla in una mole di cationi monovalenti. L'atomo che perde l'elettrone, mantiene inalterato il numero di protoni del nucleo e assume una carica positiva. Si forma uno ione positivo, o catione.. Atomo + E.I. → Atomo + + elettrone −. Cos'è l'energia di ionizzazione. L' energia di ionizzazione è l'energia necessaria per togliere un elettrone da un atomo isolato allo stato gassoso. Si chiama energia di ionizzazione perché la fuoriuscita di un elettrone trasforma un atomo neutro in uno ione positivo (catione). X(g) → X+(g)+e− X ( g) → X + ( g) + e −. Esempio.